吉林大学罗全研究团队在糖尿病慢性创面治疗研究方面取得突破性进展
吉林大学罗全研究团队在《ACS Applied Materials & Interfaces》期刊上发表了一项突破性研究,开发了一种基于分子门控的超分子纳米反应器,用于糖尿病慢性创面愈合(ACS Applied Materials & Interfaces, 2024, 16, 6315–6326)。研究通过多酶级联反应与一氧化氮(NO)气体疗法的协同作用,有效应对糖尿病创面环境的高糖、高氧化和酸性条件,显著提升创面愈合效率。
一、背景介绍
糖尿病慢性创面因其酸性、高糖和感染特性,常伴随顽固的炎症和延迟愈合,是临床治疗的重大难题。传统治疗方法往往缺乏针对性,且难以同时解决感染和组织修复问题。近年来,基于酶促反应的治疗策略因其高效性和特异性受到关注,但其应用受限于酶的不稳定性和复杂创面环境的影响。研究团队创新性地设计了一种智能靶向纳米反应器,通过对病理刺激的响应,控制内部酶级联反应以优化治疗效果,同时减少对健康组织的潜在损害。

二、仪器设备
1. 扫描电子显微镜(SEM)和透射电子显微镜(TEM):用于表征纳米反应器的形貌与内部结构,确认其中空囊泡结构及响应后的膨胀行为。
2. 动态光散射仪(DLS):用于测量纳米反应器在不同pH条件下的尺寸变化,验证其酸性环境诱导的膨胀特性。
3. 电子自旋共振波谱仪(EPR):通过DMPO自旋捕获试剂检测·OH的生成,评估酶级联反应的活性。
4. 共聚焦激光扫描显微镜(CLSM):用于观察纳米反应器在紫外光刺激下的释放行为,确认其光控释放能力。
5. 酶联免疫吸附法(ELISA):测量炎症因子(TNF-α和IL-10)的水平,分析纳米反应器对炎症反应的调控效果。
6. 超微弱发光分析仪(BPCL):结合ATP检测试剂盒,用于测量膜电位依赖的ATP合成过程,并记录发光信号,验证纳米反应器的功能效果和活性。
三、主要研究内容
研究团队设计并合成了一种基于葫芦[8]脲(CB[8])的超分子纳米反应器,用于糖尿病慢性创面的多酶级联治疗。该纳米反应器通过马来酰亚胺修饰的联吡啶(MV)和偶氮苯连接的螺旋喹啉低聚物(AHQO)自组装形成,可在酸性环境中响应性膨胀。实验表明,纳米反应器的尺寸在pH值下降时显著增大,其结构特性通过动态光散射(DLS)和扫描电子显微镜(SEM)观察得到验证。这种响应特性允许葡萄糖等小分子进入反应器,同时保护内部酶免受外部环境影响。

图1. 纳米反应器在中性条件下的扫描电子显微镜(SEM, a)和透射电子显微镜(TEM, b)图像。AHQO在不同pH条件下的折叠/展开行为触发纳米反应器的收缩/膨胀(c)。酸性pH条件下,螺旋喹啉折叠体(AHQO)形成分子内氢键(d)。AHQO在不同pH条件下的圆二色光谱(CD, e)。酸性条件下纳米反应器的SEM(f)和TEM(g)图像。纳米反应器在pH变化过程中的结构转变动力学(h)及其可逆性(i)。
在高糖酸性条件下,葡萄糖氧化酶(GOx)催化葡萄糖生成葡萄糖酸和过氧化氢(H₂O₂)。随后,H₂O₂在纳米反应器中的Fe₃O₄纳米酶作用下分解生成羟基自由基(·OH),实现高效的抗菌活性。通过电子自旋共振波谱(EPR)和化学发光(CL)实验,研究明确了·OH生成的动力学,并证实反应的高活性。同时,H₂O₂还参与氧化L-精氨酸(L-Arg),释放一氧化氮(NO),进一步调节炎症反应。
在小鼠糖尿病慢性创面模型中,研究发现,纳米反应器显著加速了创面的愈合过程。在第14天,接受纳米反应器治疗的创面面积缩小至初始面积的13.67%,而对照组仍有显著未愈区域。组织学分析显示,治疗组的炎症细胞显著减少,毛细血管密度和胶原沉积水平显著提升。同时,酶联免疫吸附实验(ELISA)结果表明,纳米反应器显著降低了炎症因子TNF-α水平,并显著增加了抗炎因子IL-10的表达。
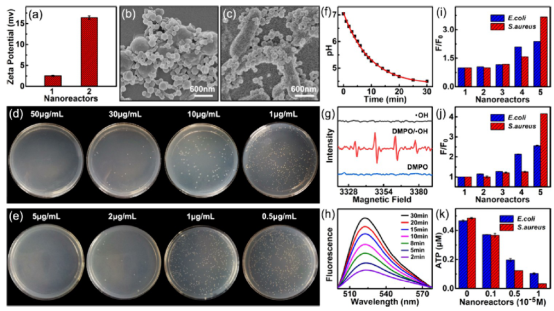
图2. (a) 未修饰纳米反应器(1)与DAPT修饰纳米反应器(2)的Zeta电位对比。(b, c) DAPT修饰纳米反应器对金黄色葡萄球菌(S. aureus)(b)和大肠杆菌(E. coli)(c)的结合亲和力。(d, e) DAPT-修饰(d)和4-MPBA-修饰(e)的纳米反应器(含GOx/Fe₃O₄)对S. aureus的最低抑菌浓度(MIC)。(f) 由4-MPBA修饰纳米反应器与GOx/Fe₃O₄催化级联反应引起的pH变化。(g) 使用DMPO作为自旋捕获试剂,通过ESR光谱检测的·OH生成情况。(h) 通过二氯二氢荧光素二乙酸(DCFH-DA)测定的·OH水平。(i, j) 纳米反应器处理S. aureus后的膜通透性(i)和膜电位(j),分别对应未修饰纳米反应器(1)、纳米反应器与Fe₃O₄(2)、纳米反应器与GOx(3)、纳米反应器与GOx/Fe₃O₄(4)、4-MPBA修饰的GOx/Fe₃O₄纳米反应器(5)。(k) 不同浓度的4-MPBA修饰两酶纳米反应器处理S. aureus后ATP水平变化。
四、结论
本研究通过构建响应性纳米反应器,成功实现了针对糖尿病慢性创面的多酶协同治疗。该策略利用酸性环境激活内部酶反应,同时释放NO以调控炎症,为顽固性创面治疗提供了一种高效、安全的新方法。未来,该技术或将在慢性疾病治疗及靶向药物递送领域展现广阔前景。
因学识有限,难免有所疏漏和谬误,恳请批评指正。
原文出处:https://doi.org/10.1021/acsami.3c12427

免责声明:
1.本文所有内容仅供行业学习交流,不构成任何建议,无商业用途。
2.我们尊重原创和版权,如有疏忽误引用您的版权内容,请及时联系,我们将在第一时间侵删处理!

